 首页>
生物试剂
首页>
生物试剂
基本信息
|
货号 |
产品名称 |
规格 |
目录价 |
|
A5001-02A-S |
Annexin V-FITC Apoptosis Detection Kit(7-AAD) |
25T |
789元 |
|
A5001-02A-L |
Annexin V-FITC Apoptosis Detection Kit(7-AAD) |
100T |
2000元 |
概述
描述:细胞凋亡是指为维持有机体内环境稳定,由基因控制的细胞自主的有序的死亡。正常情况下任何细胞在形成过程中发生的异常都会通过凋亡消除。Annexin V染色的细胞可以用于检测细胞凋亡早期的细胞膜变化。在细胞凋亡早期,磷脂酰丝氨酸(Phosphatidylserine,PS)由脂膜内侧翻向外侧。AnnexinV是一种分子量为35-36kD的Ca2+依赖性磷脂结合蛋白,与PS有高度亲和力,可通过细胞外侧暴露的PS与凋亡早期细胞的胞膜特异性结合,因此Annexin V被作为检测细胞早期凋亡的灵敏指标之一。用荧光素标记的Annexin V通过流式细胞仪或荧光显微镜可以检测到细胞凋亡的发生。7-氨基放线菌素(7-AAD)是一种核酸染料,同PI有着相似的荧光特性,但其发射光谱较PI窄,对其他检测通道的干扰更小,在多色荧光分析中是PI的最佳替代品。7-AAD只能透过凋亡晚期和坏死细胞的细胞膜,因此将Annexin V和7-AAD联合使用,就可将凋亡早期、晚期及坏死细胞区分开来。
应用范围:FC
产品组分
|
组分 |
A5001-02A-S(25T) |
A5001-02A-L(100T) |
保存条件 |
|
Annexin V-FITC |
125 µl |
500 µl |
2-8℃,避光 |
|
7-AAD |
125 µl |
500 µl |
2-8℃,避光 |
|
10× Binding Buffer |
30 ml |
30 ml |
2-8℃ |
|
Apoptosis Positive Control Solution |
5 ml |
5 ml |
2-8℃,避光 |
在上述条件下,可稳定保存1年
实验范例
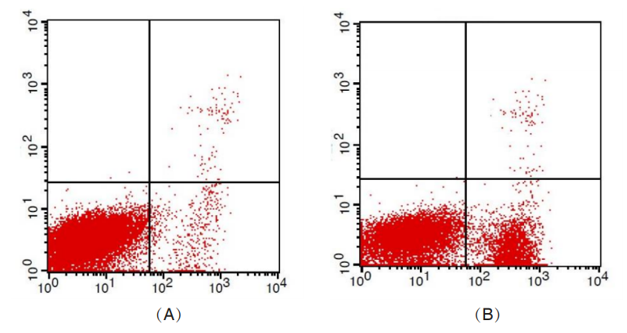
(A)未诱导Jurkat细胞 (B)用喜树碱(Camptothecin)诱导的Jurkat细胞, 按照说明书操作流程进行染色,用流式细胞仪检测结果。
操作流程
1. 根据实验要求,诱导细胞凋亡。
2. 用9ml 去离子水稀释1ml 10×Binding Buffer,配置成10ml 1×Binding Buffer,每次染色用2ml。
3. 离心收集细胞(1×10^6 个/ 次),用预冷的PBS 洗涤两次(300g 离心5min,弃上清)。对于贴壁细胞,先用胰酶消化,再用PBS 洗涤。
4. 用1ml 1×Binding Buffer 重悬细胞,使细胞的密度达到1×10^6 个/ml。
5. 取100µl 细胞悬液(1×10^5 个)至5ml 流式管中。
6. 加入5µl Annexin V-FITC 和5µl 7-AAD,轻轻混匀。在室温(25℃)下避光孵育15min。
7. 加入400µl 1×Binding Buffer 轻轻混匀,在1 小时内用流式细胞仪检测。
流式细胞仪检测
1. FITC激发波长Ex =494nm;发射波长Em =519nm,7-AAD激发波长 Ex =543nm;发射波长 Em =647nm
2. Annexin V-FITC的绿色荧光通过FL1通道检测;7-AAD的红色荧光通过FL3通道检测。
使用注意事项
1. Annexin V-FITC 和7-AAD 是光敏物质,请避光保存和使用。
2. 7-AAD 对人体有害,请穿实验服并戴一次性手套操作。
3. 细胞固定后可能导致荧光的淬灭,请不要固定样品。
4. 细胞凋亡是一个快速过程,建议样品在染色后1 h 内进行上机分析。
5. 整个操作过程动作要尽量轻柔,勿用力吹打细胞,避免对细胞造成机械性损伤。
6. 对于贴壁细胞,消化是一个关键步骤。贴壁细胞诱导细胞凋亡时如有漂浮细胞,需收集漂浮细胞和贴壁细胞后合并染色。处理贴壁细胞时要小心操作,尽量避免人为的损伤。胰酶消化时间过短,细胞需要用力吹打才能脱落,容易造成细胞膜的损伤,7-AAD 摄入过多;消化时间过长,细胞膜同样易造成损伤,甚至会影响细胞膜上PS 与Annexin V-FITC 的结合。消化时将胰酶铺满孔板底后,轻摇使胰酶与细胞充分接触,然后倒掉大部分胰酶,利用剩余少量胰酶再消化一段时间,待细胞间空隙增大,瓶底呈花斑状即可终止。在消化液中尽量不用EDTA,EDTA 会影响Annexin V 与PS 的结合。
7. 如果样品来源于血液,请务必除去血液中的血小板。因为血小板含有PS,能与Annexin V 结合,从而干扰实验结果。可以使用含有EDTA 的缓冲剂并在200 g 离心洗去血小板。
8. 因检测细胞的类型、凋亡诱导剂种类、使用的检测仪器不同,因而流式检测的荧光补偿也不同,因此建议每次检测均需使用经凋亡诱导处理的细胞作为对照,进行荧光补偿的调节(可参考说明书附页“ 如何使用凋亡阳性诱导剂调节补偿”)。
常见问题与解决方案
Annexin V-FITC阳性率偏低或者染色失败
1. 首先要确定实验中使用的诱导剂是否能产生凋亡。可通过设定确切凋亡诱导效果的阳性药物对照(可使用本试剂盒中的凋亡阳性诱导剂)来排除这一情况。
2. Annexin V-FITC 染色失败,最常见的实验操作原因是贴壁细胞消化不当。Annexin V 跟PS 的结合需要Ca2+,Binding Buffer 中含有2.5 mM的Ca2+,含EDTA 的胰酶消化会影响染色,建议使用无EDTA 的胰酶。若使用含EDTA 的胰酶,必须通过洗涤步骤彻底去除EDTA。染色时,不可使用PBS 替代Binding Buffer。
3. 如果是贴壁细胞,药物诱导后漂浮的细胞也要收集,这部分细胞往往是凋亡阳性的细胞,丢弃会造成阳性结果偏低。
4. 一些细胞其细胞膜上PS 的密度较低,染色效果很差,此时建议更换细胞株或者采用TUNEL 法检测凋亡。
假阳性
1. 实验中发现未经诱导凋亡的对照细胞经染色后Annexin V-FITC/7-AAD双阳性比例过高,造成这种结果的原因可能是细胞本身活力低。建议用台盼蓝染色计算细胞活力,未经药物处理的阴性对照台盼蓝拒染的细胞应大于95%。若细胞活力低,建议重新复苏细胞,通常刚复苏的细胞至少应传代2 - 3 次以后才能进行实验。
2. 可能是细胞操作不当引起,操作过程中吹打细胞过于剧烈,贴壁细胞消化过程中消化时间过长,均可能导致细胞膜破坏,出现假阳性。
3. 一般情况下诱导几个小时就可以出现早期凋亡,因此通常不需要处理大于48 h 以上;诱导时间过长会使营养物质耗尽,导致细胞状态差,假阳性结果偏高。
 正品保障
正品保障
高额赔付 8000万+
8000万+
试剂耗材仪器 期货精准
期货精准
现货次日到达 便捷价优
便捷价优
省钱省时省心
 京公网安备 11010802021763号
增值电信业务经营许可证:京B2-20192263
ICP备案号:京ICP备14048343号-2
Copyright© 供应室版权所有
2007-2025,All Rights Reserved
京公网安备 11010802021763号
增值电信业务经营许可证:京B2-20192263
ICP备案号:京ICP备14048343号-2
Copyright© 供应室版权所有
2007-2025,All Rights Reserved
 互联网药品信息服务资格证书: (京)-经营性-2020-0056
平台信息安全等级保护三级备案:11010813098-21001
互联网药品信息服务资格证书: (京)-经营性-2020-0056
平台信息安全等级保护三级备案:11010813098-21001
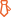


.getTime()%>)




 我的购物车(0)
我的购物车(0)

 成功收藏产品
成功收藏产品




